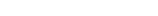1、
锂−铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O=2Cu+2Li++2OH−,其工作原理如图所示,下列说法不正确的是

A.电池放电时,正极附近溶液pH增大
B.工作时,Li+透过固体电解质向Cu极移动
C.电池放电过程中,空气中的O2并不参加反应
D.两极的有机电解质和水溶液电解质不可对换
2、
实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等。甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示。


图1 图2
(1)①事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___________(填序号,下同)。
a.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
b.2H2(g)+O2(g)=2H2O(l) ΔH<0
c.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
②甲同学设计的原电池,若将石墨棒改为铁片,则总电极反应式是否改变,若是,写出改变后总的电极反应式,若否,请写出理由:_______________________。
③乙同学设计的原电池电极反应与甲的相同,但电池的效率高很多。乙同学设计的原电池两电极分别为:a是_______(填“铜片”“铁片”或“石墨棒”,下同),b是__________。负极的电极反应式为___________________,正极的电极反应式为____________________。
(2)关于乙同学设计的原电池,下列说法中错误的是____________。
a.实验过程中,左侧烧杯中Cl−浓度增大
b.实验过程中取出盐桥,原电池不能继续工作
c.电子通过盐桥从右侧烧杯进入左侧烧杯中
3、
无机或有机含氧酸分子去掉一个或多个羟基后剩余结构称为酰基,如“—SO2—”称为硫酰(基),SOCl2、SO2Cl2、COCl2分别称为亚硫酰氯、硫酰氯和碳酰氯,它们都有很多相似的性质,如都能发生水解反应生成对应的酸、都可作氯化剂等。回答下列问题:
(1)已知:SO2(g)+PCl5(s) SOCl2(l)+POCl3(l) ΔH1=akJ·mol−1
SOCl2(l)+POCl3(l) ΔH1=akJ·mol−1
PCl5(s)+H2O(l) POCl3(l)+2HCl(g) ΔH2=bkJ·mol−1
POCl3(l)+2HCl(g) ΔH2=bkJ·mol−1
则反应SOCl2(l)+H2O(l) SO2(g)+2HCl(g) ΔH3=_________kJ·mol−1(用含a、b的代数式表示)。
SO2(g)+2HCl(g) ΔH3=_________kJ·mol−1(用含a、b的代数式表示)。
(2)①在1 L的密闭容器中充入1 mol SO2和2 mol Cl2,发生反应:SO2(g)+Cl2(g) SO2Cl2(l)。
SO2Cl2(l)。
反应达平衡后,其他条件不变,减小压强,请在下图中画出改变条件后反应速率随时间的变化曲线图。

②再次达平衡后测得SO2的转化率为35%。反应后向密闭容器中注入足量的BaCl2溶液,最终生成沉淀的质量为__________g。
(3)一定条件下存在反应:CO(g)+Cl2(g) COCl2(g)ΔH=−108kJ·mol−1,现有3个体积均为
COCl2(g)ΔH=−108kJ·mol−1,现有3个体积均为
10L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下所示投料,并在150℃条件下开始反应达平衡。
密闭容器Ⅰ(绝热恒容):1molCO,1molCl2
密闭容器Ⅱ(恒温恒容):1molCOCl2
密闭容器Ⅲ(恒温恒容):1molCO,1molCl2
①容器Ⅰ中CO的转化率与容器Ⅱ中COCl2的转化率之和_____________(填“>”“<”或“=”)1;容器Ⅱ反应的化学平衡常数为K1,容器Ⅲ的化学平衡常数为K2,K1与K2的关系为_____________。
②容器Ⅲ中反应前总压强为1atm,反应后的总压强为0.75atm,则反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
- 0.2mol某烃A在氧气中充分燃烧后,生成化合物B...
- 下列叙述正确的是A.1H和2H是不同的核素,它们的...
- 未来新能源的特点是资源丰富,在使用时对环境无污染或...
- 高纯度单晶硅是典型的无机非金属材料,又称“半导体”...
- 在固定容积的密闭容器中,放入amolX,发生反应:...
- 比较1mol氮气和1mol一氧化碳的下列物理量:①...
- 当一个碳原子连接四个不同原子或原子团时,该碳原子叫...
- 正丁醛是一种化工原料。某实验小组利用如下装置合成正...
- 下列各组物质之间能发生置换反应的是A.碘水加入氯化...
- 研究苯酚与FeCl3溶液的显色反应,实验如下。下列...
- 浓硫酸在有化学实验中频繁出现,下列实验中浓硫酸的作...
- 下列说法正确的是()A.液态HCl不导电,所以HC...
- A~D等几种烃分子的球棍模型如图所示,据此回答下列...
- CoC2O4是制备金属钴的原料。利用含钴废料(主要...
- 下列有关卤代烃的叙述正确的是A.CH2Cl2有和两...
- 某烃A是有机化学工业的基本原料,其产量可以用来衡量...
- 水合肼(N2H4·H2O)又名水合联氨,无色透明,...
- 咖啡酸具有较广泛的抑菌作用,其结构简式如图。下列关...
- 1999年,在欧洲一些国家发现饲料被污染,导致畜禽...
- 已知烯烃经臭氧氧化后,在Zn存在下水解,可得醛或酮...
- 某抗结肠炎药物有效成分的合成路线如下(部分反应略去...
- 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,...
- 对于反应2SO2+O2⇌2SO3,判断下列说法正确...
- 常见有机物A~D有下图转化关系(部分反应条件和部分...
- ClO2与Cl2的氧化性相近.在自来水消毒和果蔬保...
- 香叶醇是合成玫瑰香油的主要原料,其结构简式如下。下...
- 有A、B、C、D、E五种短周期元素,已知相邻的A、...
- 下列化学用语错误的是( )A.羟基电子式:B.乙烯...
- 下列说法中正确的是()A.用鼻子对着盛有氯气的瓶口...
- 以菱铁矿(主要成分是碳酸亚铁FeCO3)为原料制取...
- 安徽省郎溪中学高二直升部下学期第一次月考...
- 甘肃省张掖市山丹县第一中学上学期月月考-...
- 河北省鸡泽、曲周、邱县、馆陶四县高二(新...
- 陕西省西安中学高二(文科班)上学期期末考...
- 福建省永安市第三中学高二月月考化学试卷
- 云南省昭通市巧家县二中高二月月考化学试卷
- 湖北省孝感高级中学高二月调研化学试卷
- 山东省济宁第二中学高二月月考化学试卷
- 云南省麒麟高中高二月考试化学试卷
- 黑龙江省牡丹江市第一高级中学高二(理)月...
- 上海市杨浦区控江中学高二(上)期末化学试...
- 云南省云天化中学高二月月考化学试卷
- 安徽省合肥市一六八中学高二开学考试化学试...
- 甘肃省静宁县第一中学高二(普通班)上学期...
- 湖北省宜昌市葛洲坝中学高二月月考化学试卷
- 上海市行知中学高二第二学期期中考试(等级...
- 河北省鸡泽县第一中学高二月月考化学试卷
- 苏教版高二化学选修《有机化合物的命名》同...
- 广东省深圳市科学高中第一学期高二入学考试...
- 安徽省黄山市屯溪第一中学高二(理)下学期...
- 广西南宁市第三中学高二月月考化学试卷
- 北京市怀柔区上学期高二化学期末考试卷
- 河南省实验中学高二月月考化学试卷
- 广西宾阳县宾阳中学高二月月考化学试卷
- 山西省太原五中高二第二学期阶段性检测化学...
- 河北省大名县第一中学高二月月考化学试卷
- 甘肃省兰州市第一中学高二月月考化学试卷
- 上海市罗店中学高二第二学期期中考试化学试...
- 山东省济宁市高二期末模块检测化学试卷
- 浙江省丽水四校联考月高二阶段性考试化学试...

 邮箱:
邮箱: